Проводники
Проводники характеризуются хорошей электропроводностью, т. е. большим количеством свободных электрически заряженных частиц (электронов или ионов), которые могут перемещаться под действием сил поля по проводнику.
Проводники первого рода
Существуют два рода проводников. Проводниками -первого рода, в которых возможно перемещение только электронов, являются металлы. В металлических проводниках электроны, расположенные на внешних орбитах атомов, сравнительно слабо связаны с их ядрами, отчего часть электронов, оторвавшихся от своих ядер, перемещается между атомами, переходя из сферы действия одного ядра в сферу действия другого и заполняя пространство между ними наподобие газа. Эти электроны -принято называть свободными электронами или электронами проводимости. Свободные электроны находятся в состоянии беспорядочного (теплового) движения в отличие от положительно заряженных ионов металла, составляющих остов проводника, обладающих весьма малой подвижностью и совершающих лишь небольшие колебания около своего среднего положения.
Проводники второго рода
В проводниках второго рода, называемых электролитами (водные растворы кислот, солей, щелочей и оснований), под действием растворителя молекулы вещества распадаются на отрицательные и положительные ионы, которые подобно электронам в металлических проводниках могут перемещаться по всему объему проводника.
Проводники и диэлектрики. Виды проводников
Наименьшим отрицательным зарядом обладает электрон.
Для справки: заряд электрона равен e0 = -1,6021766208*10-19 Кулон
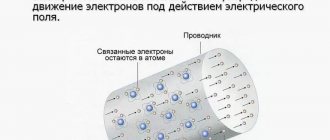
Электрон (если он слабо связан с ядром атома) может покинуть атом, перейти в междуатомное пространство, попасть в пределы другого атома и т. д. Это явление наиболее характерно для металлов. В металлах всегда имеется огромное количество беспорядочно движущихся в междуатомном пространстве электронов, называемых свободными (рисунок 1).
Рисунок 1. Хаотическое движение электронов в металле.
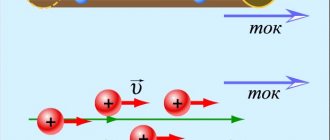
Если каким-либо способом упорядочить движение свободных электронов, то есть заставить их двигаться в одном определенном направлении, то мы и получим в металле электрический ток (рисунок 2).
Рисунок 2. Возникновение тока в проводнике.
Определение: Тела, обладающие свободными электронами, называются проводниками первого рода.
В проводниках первого рода прохождение электрического тока не вызывает химических изменений их вещества. К проводникам первого рода относятся металлы и их сплавы. Проводники первого рода нашли самое широкое применение в электротехнике и радиотехнике. Провода, шины, пластины конденсаторов, нити ламп накаливания и другие токопроводящие детали — все это делается из проводников первого рода.
Определение: К проводникам второго рода относятся растворы кислот, щелочей и солей.
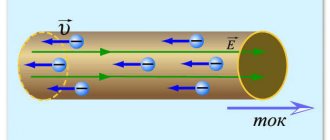
Проводники второго рода часто называют электролитами. В электролите происходит непрерывный процесс образования отрицательно и положительно заряженных молекул (ионов). Электрический ток в электролите представляет собой упорядоченное движение этих ионов (а не электронов, как это было в проводниках первого рода).
Рисунок 3. Ток в проводниках второго рода (электролитах).
Наконец, имеется большая группа веществ, которая не имеет ни свободных электронов, ни ионов. В таких веществах при обычных условиях электрический ток проходить не может, и называются они диэлектриками (фарфор, резина, слюда, стекло и т. п.).
Определение: К диэлектрикам относятся вещества, не имеющие свободных электронов.
Диэлектрики широко используются в современной электротехнике в качестве изоляторов (фарфоровые изоляторы на линиях электропередачи, резиновые покрытия проводов, слюдяные прокладки и т. д.).
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Похожие материалы:
- Строение вещества или из чего состоит материя
- Электронное строение атома
- Электрический ток в проводнике
- Сопротивление электрическому току.
Комментарии
Залим 02.05.2019 05:15 Полезно
Цитировать
Обновить список комментариев
Добавить комментарий
Диэлектрики
Вещества, число свободных электронов в которых ничтожно мало, называются непроводниками (диэлектриками или изоляторами).К ним относятся газы, часть жидких тел (минеральные масла, лаки) и почти все твердые тела, за исключением металлов и угля.
Лучшим непроводником электрического тока является вакуум. Газы, в том числе и воздух, также являются хорошими изоляторами.
ПРЕДМЕТ ЭЛЕКТРОХИМИИ.
Теория электролитической диссоциации Аррениуса. Закон разбавления Оствальда. Причины диссоциации.
Предмет электрохимии. Проводники первого и второго рода. Законы Фарадея.
Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, — электродные процессы. Можно выделить два базовых раздела электрохимии : термодинамику электродных процессов, охватывающую равновесные состояния систем электрод — раствор, и кинетику электродных процессов, изучающую законы протекания этих процессов во времени. Электрохимия изучает также теорию электролитов.
Электрохимия имеет очень большое значение, т.к. закономерности электрохимии являются теоретической основой для разработки важных технических процессов — электролиза и электросинтеза, ᴛ.ᴇ. получения химических продуктов на электродах при прохождении тока через растворы (получение хлора и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений). Важной областью практического применения электролиза является гальванотехника — электропокрытие металлами. Другая важная область техники, в базе которой лежат электрохимические процессы, — это создание химических источников тока (гальванических элементов, в т.ч. аккумуляторов), в которых химическая реакция используется как источник электрического тока.
Большое развитие получили электрохимические методы химического анализа (электроанализ, кондуктометрия, потенциометрия, полярография и др.).
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVIII и XIX в. открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первой половине XIX в. изучали электролиз. Быстрое развитие электрохимии в конце XIX в. связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию.
Для последних десятилетий характерно быстрое развитие электрохимической кинетики, изучение явлений перенапряжения, коррозии, гальванических покрытий и др.
Твердые и жидкие проводники, прохождение через которые электрического тока не вызывает переноса вещества в виде ионов, называются проводниками первого рода. Электрический ток в проводниках первого рода осуществляется потоком электронов (электронная проводимость). К таким проводникам относятся твёрдые и жидкие металлы и некоторые неметаллы (графит, сульфиды цинка и свинца).
Вещества, прохождение через которые электрического тока вызывает передвижение вещества в виде ионов (ионная проводимость) и химические превращения в местах входа и выхода тока (электрохимические реакции), называются проводниками второго рода. Типичными проводниками второго рода являются растворы солей, кислот и оснований в воде и некоторых других растворителях, расплавленные соли и некоторые твёрдые соли. Как правило, в проводниках второго рода электричество переносится положительными (катионы) и отрицательными (анионы) ионами, однако некоторые твёрдые соли характеризуются униполярной проводимостью, то есть переносчиками тока в них являются ионы только одного знака — катионы (к примеру, в AgCl) или анионы (BaCl2, ZrO2+CaO, растворы щёлочных металлов в жидком аммиаке).
Деление проводников исходя из типа проводимости (электронная или ионная) является условным. Известны твёрдые вещества со смешанной проводимостью, к примеру Ag2S, ZnO, Cu2O и др. Размещено на реф.рф В некоторых солях при нагревании наблюдается переход от ионной проводимости к смешанной (CuCl).
Проводники второго рода называются электролитами. Это бывают чистые вещества или растворы. Часто электролитами называют вещества, растворы которых проводят электрический ток. Эти растворы называют растворами электролитов.
Проводники и диэлектрики в электрическом поле
Однако при некоторых условиях, например в сильном электрическом поле, происходит расщепление молекул диэлектрика на ионы, и вещество, которое при отсутствии электрического поля или в слабом поле было изолятором, становится проводником. Напряженность электрического поля, при которой начинается ионизация молекул диэлектрика, называется пробивной напряженностью (электрической прочностью) диэлектрика. Величина напряженности электрического поля, которая допускается в диэлектрике при его использовании в электрической установке, называется допускаемой напряженностью. Допускаемая напряженность обычно в несколько раз меньше пробивной.
На электрические свойства газов оказывают сильное влияние давление и температура.
В качестве примера приведем значения пробивной напряженности в кв!см для некоторых диэлектриков: воздух — 30, масло минеральное (трансформаторное) — 50—150, электрокартон — 100, фарфор — 80-150, слюда — 800-2000.
Проводники и диэлектрики 8 класс видео:
Проводники первого и второго рода
Школьный учебник:
«В проводниках первого рода электроны перемещаются между атомами и катионами металла, которые лишь колеблются около положения равновесия. В проводниках второго рода – электролитах – заряд при протекании электрического тока переносят ионы – частички самого вещества. Не ток (а привычном понимании поток электронов) протекает в веществе, а само вещество движется, течёт, подталкиваемое электрическим полем. Притом частички этого вещества – катионы и анионы – устремляются в разные стороны. Ионы, имеющие положительный заряд, направляются к отрицательному заряженному катоду (поэтому их и называют «катодные ионы» — катионы), а отрицательные ионы движутся к положительно заряженному аноду (анодные ионы – анионы).»
— — — — — — — —
Русская теория:
Сначала – общие замечания:
У металлов нет катионов. Атомы металлов не «колеблются около положения равновесия». Заряды не существуют. «Само вещество» не подталкивается электрическим полем. Нет и самого электрического поля. Несуществующие катионы и анионы не «устремляются в разные стороны» под действием электрических сил. Нет ни электрического притяжения, ни электрического отталкивания, тоесть нет никаких электрических сил.
Проводимость металлов. Атомы металлов имеют контурные жёлобы. При слипании атомов теми же жёлобами они образуют непрерывные цепочки. По ним скользят электроны. Они смещаются под уклон электронного давления.
По жёлобу электроны скользят без энергетических потерь, так как они не приближаются к жёлобу и не удаляются от него. Трудности возникают при преодолении стыков жёлобов. Подталкивать электроны на стыках можно внешним подпором (электрическим напряжением) или накатывающимися волнами излучений.
Проводимость электролитов. В электролите действует также чистая механика. Особенности электролита состоят в том, что:
* молекулы электролита не имеют контурных жёлобов и поэтому не образуют токопроводящие цепочки;
* молекула электролита состоит из кислотного компонента, к которому присоединён атом металла или молекула водорода (молекулярный водород – тоже металл);
* атом металла присоединён к кислотному компоненту практически всегда асимметрично; поэтому при отрыве его реактивная сила поворачивает кислотный компонент в одну сторону, а под действием случайных толчков соседних молекул он может поворачиваться в обратную сторону; таким образом молекула электролита совершает поворотные движения;
* электролит – жидкий (не твёрдый и не газообразный); только в таком состоянии молекулы электролита сохраняют контакт между собой и могут совершать поворотные движения.
Перемещение электронов начинается с катода.
Под напором электронного давления они группами переходят на те молекулы электролита, которые примыкают к катоду своими атомами металлов (точнее говоря, теми частицами в составе молекул электролита, которые имеют выпуклый жёлоб). Действуя как клин, электроны отрывают эти атомы. Реактивная сила поворачивает оставшуюся часть молекулы так, что её вскрывшийся жёлоб оказывается обращённым в обратную сторону от катода. Электроны со вскрывшегося жёлоба перепрыгивают на следующую молекулу и снова, как клин, отрывают от неё атом металла. Тот под действием импульса отрыва сближается с кислотным остатком предыдущей молекулы и соединяется с ним. Чисто случайно в суматохе поворачивающихся частиц некоторые из восстановленных молекул оказываются повёрнутыми обратно в сторону катода. Процесс повторяется.
Таким образом электроны переходят (перепрыгивают) с молекулы на молекулу электролита и направляются от катода в сторону анода. При этом атомы металлов совершают переходы от одного кислотного компонента к другому в обратном направлении.
В этом процессе нет переноса электронов частицами электролита; кислотные компоненты стоят на месте; они только поворачиваются туда-сюда.
Электрический ток в проводниках второго рода
Электролитическая цепь, в которой образуется ток, всегда состоит из проводника первого рода и проводника второго рода — электролита.
Дело в том, что в проводниках второго рода, в отличии от проводников первого рода, существуют два силовых поля. Одно поле образовано под действием электростатических сил Е, другое – под действием сторонних сил Естор (пондероматорных). Энергетический баланс (основной закон сохранения и превращения энергии) может быть удовлетворен только при условии равенства этих сил!
Молекулярно-кинетическая теория – основа расчета энергии необходимой для вырывания электрона или переноса энергии одного атома к другому.
Реакции, которые идут в различного рода электролитических элементах, дают примерно одно и тоже число джоулей на каждый отдельный акт химического взаимодействия между частицами (т. е. одинаковое число джоулей на элементарный заряд). В большинстве случаев около 1·10-19 или 2·10-19 дж на элементарный заряд. Поэтому с практической точки зрения удобно принимать за единицу ЭДС такую же величину. Эта величина и называется Вольтом, т. е. 1В=1,6·10-19 дж/элем. заряд. Энергия необходимая для вырывания электрона или переноса от одного атома к другому, приблизительно равна 1 вольту, умноженному на элементарный заряд. Именно поэтому за единицу измерения энергии принят электрон-вольт. Электрон-вольт пригоден для измерения энергии «химических реакций» между отдельными частицами и энергий, требуемых для ионизации отдельных атомов. Тогда, если мы приняли за единицу энергии 1В=1,6·10-19 дж/элем. заряд, то за единицу заряда необходимо ввести новую единицу, например кулон так, чтобы произведение одного кулона на ЭДС в один вольт дало один джоуль 1 кулон·1 В=1 дж, тогда 1кулон=1 дж/1В=1,6·10-19 дж/элем. заряд=6,25·1018 элем. зарядов. При таком выборе единиц заряда сила тока является ампером, поэтому 1А=6,25·1018 элем. зарядов за секунду. В проводниках первого рода переносчиками заряда являются электроны, а в проводниках второго рода – ионы. Ток, как было выше отмечено, есть результат взаимодействия электромагнитной энергии IE c веществом, есть замкнутая субстанция и представляет собой непрерывное течение электрического заряда. Поэтому на границе полей (проводников) происходят превращения: на аноде анионы должны отдавать лишние электроны и превращаться в нейтральные атомы, а на катоде, наоборот, катионы получать электроны и превращаться в нейтральные атомы. Только в этом случае суммарный ток в электролите будет равен электронному току в металлической части цепи. Однако это явление сопровождается химическим разложением электролита и, следовательно, скорости, электропроводимость и другие параметры в проводниках второго рода будут зависеть от степени химического разложения (названной диссоциацией) электролита, и величины суммарного электрического поля Е+Естор [1].