Электрический ток в жидкостях
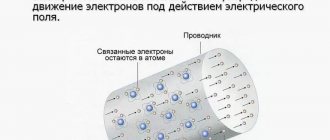
Как и твердые тела, жидкости могут быть диэлектриками и проводниками. Дистиллированная вода, например, — диэлектрик, а небольшое количество поваренной соли NaCl (тоже диэлектрик), добавленной в дистиллированную воду, делает ее проводником.
Объясняется это следующим образом. В дистиллированной воде концентрация свободных зарядов очень мала, поэтому она плохо проводит ток. Диэлектрическая проницаемость воды ε = 81, поэтому при растворении вещества в воде кулоновские силы взаимодействия ионов в молекуле соли уменьшаются. И энергии теплового (беспорядочного) движения частиц может хватить, чтобы молекула распалась на ионы Na+ и Cl–.
- Распад молекул вещества на ионы при растворении его в жидкости называется электролитической диссоциацией
.
Теория электролитической диссоциации была разработана в 1887 году немецким ученым Р. Клаузиусом и шведским химиком С. Аррениусом.
Молекулы различных веществ диссоциируют по-разному и могут распадаться на два или больше ионов. Характер диссоциации тесно связан с химическими свойствами вещества.
Например, при растворении в воде соли сульфата меди молекула CuSO4 диссоциирует на два иона: Cu2+ и SO42-:
\(~CuSO_4 \leftrightarrows Cu^{2+} + SO_4^{2-}.\)
При отсутствии внешнего электрического поля ионы находятся в тепловом хаотическом движении.
Ионы противоположного знака при встрече вновь могут образовать нейтральную молекулу. Этот процесс называется рекомбинацией
ионов (процесс, обратный диссоциации). При неизменных условиях в растворе устанавливается динамическое равновесие, когда число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Степень диссоциации
α определяется отношением числа распавшихся на ионы молекул к их общему числу. Степень диссоциации зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. Так как с ростом температуры энергия теплового движения молекул увеличивается, то при этом степень диссоциации электролита возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Пусть в сосуд с раствором электролита помещены два электрода, представляющие собой металлические проводники, к которым присоединяем источник ЭДС. Электрод, подключенный к положительной клемме источника, называется анод
, к отрицательной клемме —
катод
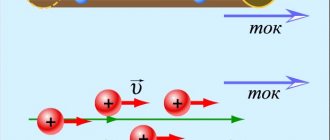
. В сосуде возникнет электрическое поле, и отрицательные ионы (анионы) начнут двигаться к аноду, а положительные (катионы) — к катоду (рис. 1). В результате в растворе электролита установится электрический ток.
Рис. 1 Термин «ион» в переводе с греческого означает «идущий». Отсюда произошли и названия «анион
» — идущий к аноду, «
катион
» — идущий к катоду.
- Электрический ток в жидкостях
— это направленное движение ионов обоих знаков.
Поскольку перенос заряда в электролитах осуществляется ионами, такую проводимость называют ионной
.
Однако некоторые жидкости могут обладать и электронной проводимостью
. Такой проводимостью обладают, например, жидкие металлы.
- Жидкости, которые проводят электрический ток, называются электролитами
.
Для электролитов также справедлив закон Ома и закон Джоуля-Ленца.
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция). Отдав или получив электроны, ионы превращаются в нейтральные атомы. Эти атомы (или образованные из них молекулы) выделяются на электродах.
Образовавшиеся атомы могут вступить в реакцию с электродами или растворителем. Химические реакции, в которые вступают нейтрализовавшиеся ионы, называются
вторичными
.
- Явление выделения на электродах веществ, при прохождении электрического тока через электролит, называют электролизом
.
Необходимым условием электролиза является прохождение через электролит постоянного электрического тока.
Электролиз впервые наблюдался в 1800 г. У.Никольсоном и А. Карлейлем, разложившими воду постоянным током. Через 7 лет Г. Дэви при помощи электролиза выделил и открыл натрий.
Лекция 2. Электропроводность электролитов
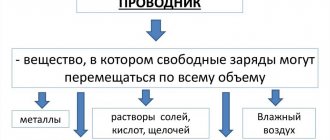
Вещества, водные растворы которых проводят электрический ток, называются электролитами.В отличие от металлов (электронная проводимость) или полупроводников (электронно-дырочная проводимость) у электролитов — ионная проводимость.
Иногда электролитами называют и сами проводящие растворы, хотя более правильное выражение — раствор электролита.
Электролитами являются соли, кислоты, щелочи и т. п., т. е. вещества, атомы в молекулах которых связаны ионными (иногда гетерополярными ковалентными связями). При растворении таких веществ в воде происходит диссоциация молекул на ионы. Причиной
электролитической диссоциацииявляется взаимодействие молекул растворенного вещества с молекулами воды. Молекула воды имеет большой дипольный момент (р = 6,1 • 10-30 Кл • м, а ε —
81), поэтому на расстоянии около 0,1 нм (среднее межмолекулярное расстояние в жидкости) вокруг молекулы воды существует довольно сильное электрическое поле. Последнее и является непосредственной причиной, ослабляющей силу электростатического взаимодействия ионов в растворенной молекуле. Энергия взаимодействия ионов в молекулах электролитов близка к энергии взаимодействия между этими же ионами и молекулами воды. Поэтому в процессе растворения соли или щелочи за счет тепловых соударений происходит распад молекул на ионы.
Положительные ионы называются катионами,отрицательные — анионами.
Процесс диссоциации идет всегда обратимо — наряду с диссоциацией имеет место и рекомбинация ионов.
Если молекулы растворенного вещества в воде не диссоциируют на ионы, то раствор не является проводником. Водные растворы сахаров, глицерина и т. п.
—
изоляторы.
Результатом диссоциации является образование сольватов.когда молекулы воды «обволакивают» ионы, образуя вокруг них сольватную оболочку (рис. 2.1).
Сольватация приводит к двум важным последствиям:
1) сольватная оболочка препятствует рекомбинации ионов, поэтому при малых концентрациях диссоциация полная:
2) наличие сольватной оболочки затрудняет движение ионов — в электрическом поле движется не ион, а сольват; заряд сольвата меньше заряда иона (экранирующий эффект сольватной оболочки), а размеры — больше.
Для возникновения электрического тока в электролите необходимо в ванну с раствором электролита опустить электроды из проводящего материала (металл, уголь и т. п.), к которым подключить источник ЭДС (рис. 2.1). Такое устройство называют гальванической, или электролитической ванной.
Процессы, происходящие вблизи электродов (на расстоянии 1-10 диаметров молекул), будут существенно отличаться от процессов в толще раствора.
Биологические жидкости являются электролитами. В этих средах под воздействием электрического поля возникает упорядоченное (направленное) движение свободных электрических зарядов (электронов, ионов или сольватов) — электрический ток.
В толще раствора положительные сольваты будут двигаться к катоду со скоростью , а отрицательные — к аноду со скоростью . Скалярной характеристикой электрического тока является
сила тока (I), равная отношению заряда (Dq), переносимого через сечение проводника или некоторую поверхность за интервал времени D t,
к этому интервалу:
(1)
Если электрический ток равномерно распределен по сечению проводника, то отношение силы тока к площади сечения проводника (S) называется плотностью тока (j):
(2)
Установим связь плотности тока с некоторыми характеристиками носителей тока, молярной концентрацией и скоростью направленного движения частиц. Запишем эту формулу для плотности потока частиц, заменив молярную концентрацию с концентрацией п:
(3)
Если эту формулу умножить на заряд qносителя тока, то произведение qJбудет соответствовать заряду, проходящему через единицу площади сечения за одну секунду, т.е. будет являться плотностью тока:
(4)
Как видно, плотность тока прямо пропорциональна заряду носителя тока, концентрации носителей и скорости их направленного движения. Естественно, что выражение (4) справедливо при равенстве зарядов носителей тока и одинаковой их скорости.
Плотность тока для электролитов следует представить в виде суммы выражений для плотности тока для положительных и отрицательных ионов, т.е. суммарная плотность тока равна:
(5)
Если предположить, что каждая молекула диссоциирует на два иона, то концентрация положительных и отрицательных ионов одинакова:
(6)
где α — коэффициент диссоциации, п— концентрация молекул электролита.
Направленное движение ионов в электрическом поле можно приближенно считать равномерным, при этом сила qE,
действующая на ион со стороны электрического поля, уравновешивается силой трения
rv
(7)
откуда, заменяя q/r
=
b,
получаем
(8)
Коэффициент пропорциональности bназываютподвижностью носителей заряда (ионов).
Он равен отношению скорости направленного движения ионов, вызванного электрическим полем, к напряженности этого поля.Подвижность носителей заряда
bсвязана с подвижностью идиффундирующих частиц соотношением b
=
uq.
Для ионов разных знаков из (8) соответственно имеем
. (9)
Подставляя (6) и (9) в (5), находим
. (10)
Представим электролит в виде прямоугольного параллелепипеда с гранями-электродами площадью S,
расположенными на расстоянии
l(рис. 2.2.). Считая поле однородным, учитывая, что
, (11)
преобразуем (10):
. (12)
Так как I = jS,
то (12) соответствует закону Ома для участка цепи без источника тока: , где
(13)
— сопротивление электролита. Сравнивая с соотношением , получаем
. (14)
Отсюда следует, что удельная проводимость электролита g тем больше, чем больше концентрация ионов, их заряд и подвижность.
При повышении температуры электропроводность электролитов растет, так как возрастает степень диссоциации и подвижность ионов, уменьшается вязкость раствора и увеличивается электропроводность.
Вблизи поверхности электрода протекают более сложные процессы, которые являются скорее электрохимическими, чем чисто физическими:
а) на аноде происходит электроокисление анионов, на катоде — электровосстановление катионов, а также происходит еще ряд электрических процессов; в целом эти процессы называют поляризационными явлениями;
б) вблизи поверхности электродов могут идти также вторичные химические реакции.
При достаточно малых потенциалах на электродах не идут окислительно-восстановительные процессы, поэтому для гальванической ванны в целом существуют области потенциалов, где зависимость тока от напряжения не подчиняется закону Ома.
При достаточно больших потенциалах может начаться выделение вещества на электродах в виде осадка (осаждение на электроде) или газа. Количественно эти процессы описываются законами Фарадея.
Первый закон Фарадея: масса выделившегося на электроде вещества пропорциональна электрическому заряду, протекающему через электролит:
(15)
где М — масса вещества, q — заряд, I — сила тока и t — время. Коэффициент k, называемый электрохимическим эквивалентом вещества, показывает, какая масса вещества выделится на электроде при прохождении через электролит заряда, равного 1 Кл.
Второй закон Фарадея: электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам:
(16)
где А — атомный вес элемента; Z — его валентность: A/Z — химический эквивалент элемента.
Число Фарадея F численно равно электрическому заряду, который должен пройти через электролит, чтобы на электроде выделился один килограмм-эквивалент вещества. F = 9,6487×107 Кл/кг-экв.
В результате электровосстановления или электроокисления ионов электролита на электродах образуются электронейтральные атомы, которые вовсе необязательно будут осаждаться на электродах или выделяться в виде пузырьков газа — они могут вступить в химические реакции с раствором вблизи электрода. Такие процессы и будут вторичными реакциями.
Все эти процессы находят применение в различных отраслях техники, многие из них используются также в медицине
Законы электролиза
Электролиз описывается двумя основными законами, экспериментально установленными Фарадеем в 1833-1834 годах.
Первый закон Фарадея
:
- масса вещества m, выделившегося на одном из электродов, прямо пропорциональна заряду Δq
, прошедшему через электролит:
m = K⋅Δq = K⋅I
⋅Δ
t
.
Здесь I
— сила тока в электролите, Δ
t
— время протекания тока через электролит,
K
— электрохимический эквивалент вещества.
- Электрохимический эквивалент
численно равен массе вещества
m
, выделившегося на электроде при прохождении через раствор электролита заряда
q
в 1 Кл. В СИ единицей электрохимического эквивалента является килограмм на кулон (кг/Кл).
Таблица 1.
Электрохимические эквиваленты веществ
| Вещество (анионы) | K, 10–6 кг/Кл | Вещество (катионы) | K, 10–6 кг/Кл |
| Гидроксил (OH–) | 0,177 | Алюминий (Al3+) | 0,0932 |
| Кислород (O2–) | 0,0829 | Водород (H+) | 0,1045 |
| Кислотный остаток (SO42–) | 0,499 | Железо (Fe3+) | 0,193 |
| Сера (S2–) | 0,167 | Золото (Au3+) | 0,681 |
| Хлор (Cl–) | 0,367 | Медь (Cu2+) | 0,329 |
| Натрий (Na+) | 0,238 | ||
| Никель (Ni2+) | 0,30 | ||
| Серебро (Ag+) | 1,11 | ||
| Ртуть (Hg+) | 2,079 | ||
| Цинк (Zn2+) | 0,339 |
Второй закон Фарадея:
- электрохимический эквивалент вещества K
прямо пропорционален его химическому эквиваленту:
\[K=C\cdot \dfrac{M}{Z} .\]
Здесь С
— коэффициент пропорциональности, постоянная величина, отношение $\dfrac{M}{Z} $ — химический эквивалент,
M
— молярная масса вещества,
Z
— валентность вещества.
Этот закон обычно записывают в ином виде, учитывая, что $C = \dfrac{1}{F}$, где F
получила название постоянной Фарадея:
\[K=\frac{1}{F} \cdot \dfrac{M}{Z} .\]
- Постоянная Фарадея F
равна произведению элементарного заряда
e
на число Авогадро
NA
:
F = e⋅NA
,
F
= 9,65⋅104 Кл/моль.
Законы Фарадея сыграли важную роль в истории развития физики. Они послужили толчком к выдвижению гипотезы о существовании в природе элементарного электрического заряда и позволили впервые определить его значение.
См. так же
- Кикоин А.К. О числе Фарадея и удельном заряде заряженной частицы //Квант. — 1985. — № 2. — С. 25-26
Ток в электролитах и газах. Потенциал ионизации. Закон Ома для электролитов и газов. Электрофорез.
Если в электролит или расплав ввести две твердотельных пластинки (электроды) и подать на них напряжение, то возникает электрический ток, который создаётся направленным движением ионов. Достигнув соответствующих электродов, ионы отдают или приобретают электроны и превращаются в нейтральные атомы или молекулы. В результате химических реакций вторичные продукты либо оседают на электродах, либо переходят в раствор. Явление осаждения составных частей электролита на электродах получило название электролиза.
Материалы, в которых при прохождении тока происходят химические превращения, относятся к проводникам второго рода.
Количественно электролиз описывается законами Фарадея:
, , (19)
где m – масса осевшего на электроде вещества, k – его электрохимический эквивалент, i
= f(t) – сила тока, t – время его протекания, F – число Фарадея (F = 96,497∙10 6 Кл/моль.), М – молярная масса вещества, z – валентность, F/z – называется химическим эквивалентом вещества.
Если величина тока I в процессе электролиза не меняется, то (18) принимает вид:
(20)
В растворе процессы диссоциации и рекомбинации идут параллельно. В конечном итоге в растворе при постоянных внешних условиях устанавливается динамическое равновесие. Этому состоянию соответствует определенная степень диссоциации, которую принято характеризовать коэффициентом диссоциации – α, который показывает долю распавшихся молекул растворенного вещества – α = n ‘ / n. При невысоких температурах ионы бывают окружены облепившими их ионами растворителя. Это явление получило название сольватации (для водных растворов – гидратации), а сам комплекс из иона и удерживаемой его силовым полем оболочки из молекул растворителя называют сольватом.Отношение
(21)
называется подвижностью ионов,
которая представляет среднюю
скорость дрейфа заряженных частиц в поле с напряженностью 1 В/м). = м 2 / (В·с). Подвижность ионов b зависит от их природы, свойств растворителя и температуры. Для установившегося движения плотность тока в электролите будет:
Применение электролиза в технике
Электролиз находит широкое применение в технике.
Очистка или рафинирование металлов
. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой «потенциалом разложения». При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия
. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия
— электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика
, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
Электролитическим путем получают тяжелую воду (D2O), в которой атомы водорода заменены атомами его изотопа — дейтерия (D) с атомной массой 2.
См. так же
- Мякишев Г.Я. Физика: Электродинамика //§3.6. Техническое применение электролиза
Какие вещества являются электролитами. Электролиз
Положительно и отрицательно заряженные ионы являются носителями свободных зарядов в электролитах. Соединения металлов в расплавленном состоянии, некоторые твердые вещества относят к электролитам. Основными их представителями являются водные растворы неорганических кислот, солей, оснований. Их широко применяют в технике.
При прохождении электрического тока через электролит происходит одновременное выделение веществ на электродах. Данное явление получило название электролиза.
Электрический ток в электролитах рассматривается как перемещение ионов с обоими знаками в противоположных направлениях.
Движение положительных ионов направлено к отрицательному электроду (катоду), а отрицательных – к положительному электроду (аноду). Появление ионов с противоположными знаками в водных растворах солей, кислот, щелочей является следствием расщепления нейтральных молекул. Явление получило название электролитической диссоциации.
При диссоциации в водном растворе хлорида меди CuCl 2 на ионы меди и хлора получаем выражение:
CuCl 2 ⇄ Cu 2 + + 2 Cl — .
Рисунок 1 . 15 . 1 показывает принцип упорядоченного движения положительных ионов меди к катоду, а отрицательных ионов хлора – к аноду вследствие подключения электродов к источнику тока при действии электрического поля на эти ионы.
После достижения катода ионы меди нейтрализуются избыточным количеством его электронов и переходят в состояние нейтральных атомов, оседающих на катоде. Ионы хлора, добравшись к аноду, отдают по одному электрону. После чего происходит соединение попарно нейтральных атомов хлора для образования молекулы хлора Cl 2 . Его наличие обусловлено выделением пузырьков на аноде.
Многие реакции электролиза сопровождаются вторичными реакциями продуктов разложения, которые выделяются на электродах, с его материалом или растворителями.
Примером может служить электролиз раствора сульфата меди (медного купороса) CuSO 4 при опущенных в электролит электродов, изготовленных их меди.
Диссоциация молекул сульфата меди идет согласно формуле:
CuSO 4 ⇄ Cu 2 + + SO 4 2 — .
Нейтральные атомы меди оседают в виде твердого осадка на катоде. Таким образом получается химически чистая медь. При отдаче ионом SO 4 2 — двух электронов аноду становится нейтральным радикалом SO 4 , который вступает во вторичную реакцию с медным анодом:
SO 4 + Cu = CuSO 4 .
Получившаяся молекула сульфата меди переходит в раствор. Это показывает прохождение электрического тока через водный раствор сульфата меди для растворения медного анода и оседания меди на катоде. Концентрация данного раствора не меняется.
Рисунок 1 . 15 . 1 . Электролиз водного раствора хлорида меди.
Литература
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 282-287.
- Буров Л.И., Стрельченя В.Μ. Физика от А до Я: учащимся, абитуриентам, репетиторам. — Мн.: Парадокс, 2000. — C. 228-232.
- Жилко, В. В. Физика: учеб. пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В. В. Жилко, А.В. Лавриненко, Л. Г. Маркович. — Мн.: Нар. асвета, 2002. — С. 258-263.